В последние годы наблюдается огромный интерес к микроводорослям, синтезирующим высокое количество каротиноидов. Таковыми называют одноклеточные зеленые водоросли (Dunaliella, Haematococcus), накапливающие, обычно под влиянием неблагоприятных условий, высокие (до 6% сухого веса) количества вторичных каротиноидов. Индукция синтеза высоких количеств каротиноидов, называемая также каротиногенезом, является характерным ответом одноклеточных водорослей, особенно представителей класса зеленые водоросли (Chlorophyta), на действие стрессоров разнообразной природы (интенсивное освещение, высокая соленость, УФ излучение, экстремальные температуры) [1-6]. Считается, что каротиногенез, наряду с прочими ответами на действие стрессоров, является адаптивной реакцией, обеспечивающей выживание микроводорослей в экстремальных условиях среды обитания. Так, для исследования каротиногенеза в качестве объектов часто используют различные микроводоросли, в частности (Chlorella nivalis, Chloromonas rubroleosa, Parietochloris incise и ряд других) способные расти при температурах, близких к 0оС [7,8]. В этих условиях окраска водорослей изменяется с зеленой на различные оттенки желто-оранжевого и красного цветов, вследствие индукции синтеза каротиноидов в больших количествах. Среди пигментов, накапливаемых различными микроводорослями в условиях стресса, чаще всего встречаются β-каротин (у представителей рода Dunaliella [1]), астаксантин (у видов Haematococcus [4]), а также ряд других каротиноидов и их производных.
Накопление β-каротина у зеленых водорослей, таких как Dunaliella salina и Dunaliella bardawil [9], а также Haematococcus, индуцируется, помимо сильного света, высокой соленостью, дефицитом минерального питания и низкими температурами, то есть условиями снижающими эффективность фотосинтеза и повышающими риск фотоингибирования [10]. Известно, что синтез β-каротина у этих водорослей можно индуцировать искусственно даже при низких освещенностях, если обработать их клетки красителями-генераторами АФК (метиленовым синим и бенгальским розовым), напротив, добавление в среде тушителей 1О2 (гистидина или эозина) ингибирует каротиногенез у Haematococcus при высокой освещенности и дефиците минерального питания [11]. Таким образом, представляется вероятным участие образующегося при фотосинтезе 1О2 в индукции каротиногенеза у микроводорослей в неблагоприятных условиях. [11,12]. У гиперпродуцентов β-каротина выявлена координированная регуляция различных ответов на действие стрессоров – синтеза высоких количеств каротиноидов и экспрессии белков светособираюшего комплекса, связывающих зеаксантин, а также белков-стабилизаторов липидных глобул, в которых откладывается β-каротин [13].
Целью работы являлось изучение синтеза суммы каротиноидов клетками Dunaliellа, выращенные в минеральной среде с добавлением 1,0 М; 1,5М и 3,0М NaCI, их биопродуктивности, резистентности культуры к хроническим дозам УФ-В излучения, влияния низкотемпературного стресса, а также их фотосинтетической активности при высоких температурах.
Материалы и методы исследования
Объектом исследования служила галофильная зеленая микроводоросль Dunaliella salina IPPAS D-294, выделенная из соленого озера Масазыр находящегося на северо-западе территории города Баку.
В условиях хронических доз УФ-В излучения водоросли выращивали при 27оС в фотореакторах (250 мл), из обычного (контрольные суспензии) и кварцевого (опытные суспензии) стекла, на установке для выращивания культур одноклеточных водорослей. Источником УФ-В излучения служила ртутная лампа СВД-120, снабженная светофильтром УФС-2. Хроническое УФ-В облучение клеток проводили круглосуточно, с помощью часового механизма. Минеральная среда содержала (г/л): NaCI – 58,5 (1,0 М); 87,5 (1,5 М) и 175,5 (3,0 М); KNO3 – 5,0; KH2PO4 – 1,25; MgSO4 – 50; FeSO4 – 0,009 раствор микроэлементов (мг/л) – Ca(NO3)2 • H2O – 735; H3BO3 – 735; ZnSO4 • 7H2O – 615; (NH4)MoO4 – 100; MnCl2 • 4H2O – 180. Суспензию клеток в фотореакторах в течение 24 часов освещали белым светом (16 Вт/м2) и непрерывно продували смесью (воздух +1,5% СО2) с температурой 25оС для контрольных и в условиях низкотемпературного стресса 10оС; 5оС для опытных суспензий. Клетки выращивали в течение 24 часов, в интенсивно-накопительном режиме культивирования и освещали круглосуточно. Рост культуры определяли периодическим подсчетом числа клеток в камере Горяева под микроскопом или нефелометрическим измерением оптической плотности суспензии на фотоэлектроколориметре.
Содержание пигментов в клеточных экстрактах (100% ацетон) измеряли на спектрофотометре и рассчитывали на основании коэффициентов Ветштейна [14].
Для измерения фотосинтетической активности клеток, выращенные водоросли осаждали центрифугированием 3000 об/мин в течение 10 минут при комнатной температуре и переносили на свежеприготовленную минеральную среду. Плотность суспензии клеток доводили до 106 кл/мл (оптическая плотность ОD = 0,8). Скорость выделения кислорода клетками измеряли на полярографической установке, с применением платинового электрода Кларка, освещая суспензию в термостатированном объеме, белым светом насыщающей интенсивности (100 Вт/м2).
Результаты исследования и их обсуждение
Зависимость накопления каротиноидов в клетках Dunaliella salina IPPAS D-294 от концентрации NaCI в среде. Исследование эколого-физиологических, биохимических и цитологических особенностей видов Dunaliella, позволяют пролить свет на механизмы галотолерантности. Известно, что эти организмы, развиваются в условиях чрезвычайно высокой солености среды (1-4 М NaCl), что делает интересным выяснение особенностей её структурно-функциональной организации, изучения механизмов осморегуляции, адаптации водорослей к осмотическому действию среды и в определенных экологических условиях, способностью к направленному синтезу β-каротина. Предварительное воспитание посевного материала позволяет определять границы солеустойчивости клеток Dunaliellа и раскрыть ростовой концентрационный оптимум. Под влиянием неблагоприятных факторов внешней среды (низкой температуры, избытка солей) в клетках Dunaliellа возрастает содержание глицерина [15]. При этом характерное накопление глицерина в цитоплазме, как осморегулирующее вещество, тесно коррелирует с концентрацией солей в среде обитания водоросли. Изучение кинетики роста популяции клеток Dunaliella salina IPPAS D-294 при различных соленостях среды в интенсивно-накопительном режиме культивирования показало, что максимальная продуктивность наблюдается при концентрации NaCI (1,5 М) в минеральной среде (рис. 1). Интересно отметить, что уменьшение концентрации NаСI (1,0 М) в минеральной среде приводит к снижению показателей биосинтеза суммы каротиноидов (12%) и темпа роста культуры на (20-22%).
Высокие концентрации хлористого натрия в питательной среде 3,0 М приводит к заметному повышению синтеза суммы каротиноидов (30%) и снижению скорости суточного прироста на 20-25% водорослей. Следует отметить, что, несмотря на снижение скорости роста, биопродуктивность культуры остается на достаточно высоком уровне.
Исследование количественных показателей синтеза суммы каротиноидов в клетках Dunaliellа от концентрации NаСI показало, что в этих условиях клетки сохраняют типичную для них ответную реакцию, и при повышении концентрации NаСI в среде в них увеличивается сумма каротиноидов. При этом также обращает на себя внимание обратная корреляция между накоплением суммы каротиноидов в клетках и роста культуры.
Влияние различных доз хронического УФ-В излучения на накопление суммы каротиноидов в клетках Dunaliella salina IPPAS D-294. В связи с истощением озонового слоя наблюдается повышение доз УФ-В излучения на поверхности Земли и нарушению функции растительного организма. УФ-В радиация является одним из экологических факторов, разнонаправленно влияющих на популяции одноклеточных водорослей и растений. Необходимо вычленить из совокупности экологических факторов специфические особенности и механизмы действия УФ-В излучения на популяционном уровне. На рисунке 2, представлены зависимости показателей роста и суммы каротиноидов в клетках Dunaliella от хронических доз УФ-В излучения при интенсивном культивировании. На кривой доза-эффект наблюдается подавление роста популяции клеток микроводорослей (рис. 2, кривая 1). Увеличение дозы УФ-В излучения в исследованном диапазоне сказывается на выживаемости популяции, так при хронической дозе 15·103 Эрг/мм2 в час она составляет 85% от контроля.
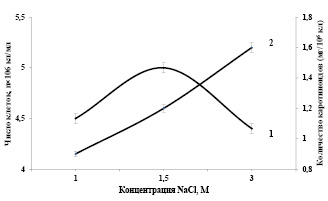
Рис. 1. Зависимости показателей роста (1) и биосинтеза суммы каротиноидов (2) в клетках Dunaliella от концентрации NaCl (M) в минеральной среде. Температура 27оС, интенсивность света 16 Вт/ м2
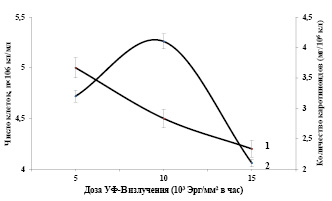
Рис. 2. Зависимости показателей роста (1) и биосинтеза суммы каротиноидов (2) в клетках Dunaliella от хронической дозы УФ-В излучения в интенсивной культуре. Температура 270С, интенсивность света 16 Вт/ м2
При действии хронических доз УФ-В радиации на популяцию клеток Dunaliella получены результаты зависимости биосинтеза суммы каротиноидов от хронической дозы УФ-В излучения, представленные на рисунке 2, (кривая 2). Как видно из рисунка, эта зависимость описывается одновершинной кривой с максимумом при хронической дозе УФ-В радиации (10·103 Эрг/мм2 в час). Биосинтез суммы каротиноидов в опытных клетках в интенсивной культуре при хронической дозе УФ-В излучения 5·103 Эрг/мм2 в час составляет 3,2 мг/106кл. Эти количества превышают контрольные клетки (1,5 мг/106кл) в 2 раза. Максимальные количества синтезированных клетками суммы каротиноидов (4,1 мг/106кл) наблюдается при хронической дозе 10·103 Эрг/мм2 в час.
В условиях интенсивной культуры, увеличение хронической дозы УФ-В света до 15·103 Эрг/мм2 в час снижает суммы синтезированных каротиноидов популяцией клеток Dunaliella. На основании полученных результатов можно заключить следующее, выращивание водорослей в интенсивной культуре при различных хронических дозах УФ-В излучения, позволили нам получить клетки, обогащенные каротиноидами.
Влияние низкотемпературного стресса на синтез суммы каротиноидов в клетках Dunaliella salina IPPAS D-294 в интенсивной культуре. В настоящее время существует обширнейшая литература по проблеме устойчивости живых организмов к низким температурам. Значимость проблемы обусловлена тем, что значительная часть территории суши (около 65%) растения испытывают губительное действие низких температур.
Необходимо отметить, что определенная часть повреждений при низкотемпературном стрессе обусловлена действием образующихся в клетке во время стресса активных форм кислорода в результате активации процессов перекисного окисления липидов, вызывающих структурные изменения мембран. Выращивание контрольной суспензии клеток при оптимальных условиях (температура 27°С, интенсивность света 16 Вт/м2, парциальное давление углекислоты, минеральная среда) в 250 мл стеклянных фотореакторах и подаче воздушной смеси с температурой 25°С в периодически-накопительном режиме культивирования в течение 24 часов показали, что оптическая плотность клеточной суспензии увеличивается в 3,5-4 раза [16]. На рисунке 3 представлены зависимости показателей роста и биосинтеза суммы каротиноидов в клетках Dunaliella от температуры воздушной смеси подаваемые в фотореакторы при интенсивно-накопительном режиме культивирования. Как видно из рисунка, снижение температуры воздушной смеси, подаваемые в фотореакторы до 10°С и 5°С, значительно подавляют рост и биопродуктивность клеточной суспензии на 10% и 18-20% соответственно (рис. 3, кривая 1).
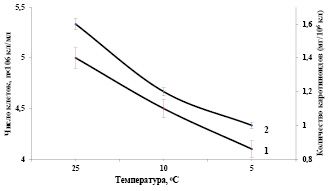
Рис. 3. Зависимости показателей роста (1) и биосинтеза суммы каротиноидов (2) в клетках Dunaliella от температуры воздушной смеси подаваемые в фотореакторы при интенсивно-накопительном режиме культивирования. Температура 27оС, Интенсивность света 16 Вт/ м2.
В результате воздействия низкой положительной температуры (10оС) в клетках Dunaliella наблюдается деградация суммы каротиноидов, по отношению к контрольным клеткам (рис. 3, кривая 2). Необходимо отметить, что при снижении температуры воздушной смеси, подаваемые в фотореакторы до (5оС), наблюдается значительное снижение биосинтеза суммы каротиноидов клетками Dunaliella salina IPPAS D-294. Таким образом, низкие положительные температуры (10оС) и (5оС) воздушной смеси подаваемые в фотореакторы, в интенсивно-накопительном режиме культивирования снижают биопродуктивность популяции и биосинтез суммы каротиноидов клетками.
Каротиноиды повышают функциональную устойчивость клеток Dunaliella salina IPPAS D-294 при высоких температурах. Культивируемые растения редко растут при оптимальных условиях. Обычно они подвергаются одновременному действию нескольких стрессов. Разнообразные ответные реакции растений на эти стрессы могут быть аддитивными, синергическими или антогонистическими.
Задачей исследований являлось выяснение роли суммы синтезированных каротиноидов в клетках Dunaliellа, выращенных при различных соленостях среды и хронических дозах УФ-В излучения, при изучении их функциональной устойчивости к высокой температуре. Влияние неблагоприятных факторов внешней среды (низкая температура, избыток солей, УФ излучение) сильно сказывается на функциональной активности клеток Dunaliellа. На рисунке 4 представлены результаты изучения зависимости показателей фотосинтетического выделения кислорода клетками Dunaliella, выращенные при интенсивно-накопительном режиме культивирования с 1,5М NaCI в минеральной среде (1), высоких концентрациях NaCI (3,0М) в минеральной среде (2) и в условиях хронической дозы 10 Эрг/мм2 УФ-В излучения (3) от температуры. Как видно из рисунка, фотосинтетическая активность клеток, выращенных при высоких концентрациях NaCI (3,0 М), проявляют относительно низкие показатели скорости выделения кислорода, по сравнению с клетками, выращенными в 1,5М NaCI. Это связано, с высоким количеством синтезированных клетками суммы каротиноидов, которое сказалось на соотношении хлорофиллы/каротиноиды, характеризующие показатели фотосинтетической активности.
Изучение зависимости выделения кислорода клетками, выращенные в среде с 1,5 М NaCI, от температуры показало, что температура 40оС фотосинтетического выделения кислорода для этих водорослей является оптимальной. При температуре (42,5оС), фотосинтетическое выделение кислорода клетками снижается до (75%). А при температуре 45оС эта величина составляет всего лишь 30% (рис. 4, кривая 1).
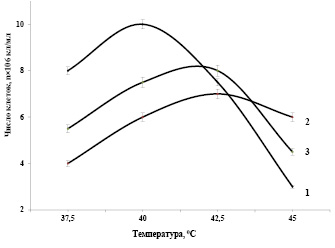
Рис. 4. Зависимости показателей фотосинтетического выделения кислорода клетками Dunaliella, выращенные при интенсивно-накопительном режиме культивирования с 1,5 М NaCI в минеральной среде (1), высоких концентрациях NaCI (3,0 М) в минеральной среде (2) и в условиях хронической дозы (10 Эрг/мм2в час) УФ-В излучения (3) от температуры. Интенсивность света 100 Вт/ м2.
Изучение температурной зависимости фотосинтетической активности клеток, выращенные при высоких концентрациях NaCI (3,0 М) показали, что при 40оС выделение кислорода водорослями составляет 90% от максимального значения, увеличение температуры до 42,5оС повышает фотосинтетическую активность водорослей до максимального уровня. При дальнейшем повышении температуры 45оС выделение кислорода клетками подавляется и составляет 95% от максимального показателя (рис. 4, кривая 3).
Выращивание клеток в минеральной среде с 3,0 М NaCI, приводит к синтезу повышенных количеств каротиноидов. Эти клетки смещают температурный максимум фотосинтетического выделения кислорода с 40оС (при оптимальной концентрации хлористого натрия 1,5 М для данного штамма) до 42,5оС. Это дает нам основание считать, что синтезированные в клетках каротиноиды выполняют роль протекторов, при экстремально высоких температурах.
Изучение зависимости выделения кислорода клетками, выращенными в условиях различных хронических доз УФ-В света, от температуры показали, что при оптимальной температуре (40оС), контрольные клетки проявляют высокий потенциал фотосинтетической активности (рис. 4, кривая 2). Предварительные исследования фотосинтетической активности клеток, выращенные при хронической дозе УФ-В излучения 5 Эрг/мм2 в час в интенсивной культуре, показали с повышением температуры от оптимальной величины 40оС популяция водорослей проявляет некоторую функциональную устойчивость. Эта функциональная устойчивость четко прослеживается на кинетики фотосинтетического выделения кислорода клетками при температуре 42,5оС, которая превышает контрольные суспензии на 6-9%. Увеличение хронической дозы до 10 Эрг/мм2 в час, несколько снижает темп роста культуры, но сохраняет повышенную функциональную устойчивость к экстремальным температурам. В данном случае наблюдается смещение максимума фотосинтетической активности клеток в сторону высоких температур 42,5оС (рис. 4, кривая 3). Дальнейшее повышение температуры 45оС подавляет выделение кислорода клетками до уровня 65%.
На основании полученных данных можно заключить, что устойчивость клеток к высоким температурам, вероятно, связано с действием УФ-В света или повышенным количеством синтезированных водорослями суммы каротиноидов в условиях хронического УФ-В облучения, т.е. синтезированные каротиноиды позволяют водоросли расширить диапазон температурной устойчивости и защите водорослей от стресса, вызванного высокой температурой. Такое предположение было сделано авторами [17], где сказано, каротиноиды вызывают снижение жидкостности на периферии тилакоидных мембран, тогда как подвижность липидов в центральной гидрофобной части остается практически без изменений. Такое разжижение мембран, находящихся в состоянии геля, и делают более жесткими мембраны в жидко-кристаллической фазе, и таким образом, расширяя диапазон температурной устойчивости.
Библиографическая ссылка
Али-заде Г.И., Джалилова А.Р., Алиев И.И., Магеррамова Х.Х. КАРОТИНОГЕНЕЗ У КЛЕТОК DUNALIELLA В СТРЕССОВЫХ УСЛОВИЯХ // Рациональное питание, пищевые добавки и биостимуляторы. 2016. № 2. С. 5-11;URL: https://journal-nutrition.ru/ru/article/view?id=35729 (дата обращения: 04.03.2026).

